组蛋白变异体
1977年,Franklin和Zweidler首次使用酸-尿素-三联物X(AUT)聚丙烯酰胺凝胶电泳从哺乳动物组织中分离出组蛋白变异体 [1]。组蛋白具有广泛的功能,包括基因表达、染色体分离、DNA修复和其他真核生物基本染色体过程。这些染色体过程的独特需求推动了特定组蛋白变异体的出现。将这些变异体组蛋白整合到核小体中产生了染色质结构的巨大多样性。
1. 什么是组蛋白变异体?
组蛋白变异体是核心组蛋白的非等位基因异构体,它们在基因组的战略位置取代它们的经典组蛋白对应物。组蛋白变异体与核心组蛋白的不同之处在于,它们的差异范围从氨基酸的轻微改变到结构上的重大差异。通常,经典组蛋白通常在基因组复制期间合成,其表达在S期达到高峰,而组蛋白变异体在整个细胞周期中表达,并以一种与复制无关的方式整合到染色质中。一些组蛋白变异体表现出组织特异性表达,限制在生殖细胞中。
通常,真核生物基因组中含有大量的复制相关(RC)组蛋白,而组蛋白变异体的数量有限,通常只有一个或几个拷贝。虽然组蛋白变异体与它们的RC组蛋白对应物具有相似之处,但它们在其组蛋白折叠域(HFDs)方面显示出明显的特征,从而使它们在序列和功能方面有所区别。
此外,组蛋白变异体在其N-和C-末端尾部通常显示出更大的差异。这些差异导致它们与不同的伴侣蛋白结合以进行沉积,并施加不同的翻译后修饰。因此,这些变化赋予了组蛋白变异体通过改变染色质特性而具有的专门功能 [4,5]。
2. 组蛋白变异体的分类
所有组蛋白都可以存在为变异体,但复制相关(RC)组蛋白分化为组蛋白变异体的程度并不均匀。在哺乳动物中,有许多H2A变异体,较少的H3变异体,甚至更少的H2B和H4变异体。这种不均匀的分化可能与每种组蛋白在核小体中的位置及其在替代后修改核小体性质的潜力有关。
| 经典组蛋白 | 组蛋白变异体 | 功能 | |
|---|---|---|---|
| H2A | H2A.X | 分布在基因组各处,DNA修复,性染色体重塑 | |
| H2A.Z | H2A.Z.1 | 转录调控,异染色质组织,染色体分离,基因组稳定性,细胞增殖 | |
| H2A.Z.2 | 转录调控 | ||
| H2A.Bbd | 限制于脊椎动物,不包括非活性X染色体,转录激活 | ||
| macroH2A1.2 | 限制于脊椎动物,位于雌性哺乳动物细胞中非活性X染色体,转录抑制和高阶染色质紧缩 | ||
| H2A.J | 与细胞增殖和炎症相关的基因表达 | ||
| H2A.B | 核小体解稳定,活跃转录,DNA修复,DNA复制,剪接,精子发生 | ||
| mouse H2A.L (H2A.L.2) | 精子发生,H2A.L2显示的组蛋白到蛋白转变 | ||
| H2A.P | 睾丸特异性 | ||
| H2A.W | 植物特异性;保护比大多数核小体的147个碱基对多出的10-15个碱基对的连接区DNA | ||
| H2B | H2B.E | 小鼠气味感受神经元 | |
| H2B.W | 睾丸特异性 | ||
| TH2B | 睾丸特异性,组蛋白到蛋白转变 | ||
| H2B.3 | 在成熟叶片中富集,以及含有H3.3和/或H2A.Z的核小体 | ||
| H2B.8 | 在干燥的种子中富集 | ||
| H3 | H3.1 | 经典型,复制依赖性 | |
| H3.2 | 经典型,复制依赖性 | ||
| H3.3 | 与细胞周期无关,转录激活,端粒,着丝粒 | ||
| H3T (H3.4) | 睾丸特异性,在精母细胞和精子细胞中表达,在精子发生过程中的染色质转变动态中起作用 | ||
| mouse H3t | 精子发生 | ||
| H3.5 | 位于人类染色体12的12p11.21区域,主要在生殖阶段VI-X的精原细胞和初级精子细胞中表达,精子发生,转录调控, 在各种组织中弱表达 | ||
| H3.6 | 在各种组织中弱表达 | ||
| H3.7 | 在各种组织中弱表达 | ||
| H3.8 | 在各种组织中弱表达 | ||
| H3.X | 位于人类染色体5的5p15.1区域,转录调控,调节细胞周期 | ||
| H3.Y | 位于人类染色体5的5p15.1区域,转录调控,调节细胞周期 | ||
| CENP-A (CenH3) | 着丝粒特异性,有助于有丝分裂期间着丝粒组装和染色体分离 | ||
| H3mm7 | 小鼠H3.3亚变体,表达在骨骼肌卫星细胞中 | ||
| H4 | H4-G | rDNA转录的上调 | |
| H1 | H1.1 | - | |
| H1.2 | 在小鼠胚胎干细胞中,H1.2和H1.3富集在H3K9me3标记的异染色质域上,通过阻滞RNAPII的转录,促使外显子的包含 | ||
| H1.3 | |||
| H1.4 | |||
| H1.5 | 在人肺成纤维细胞中,H1.5富集在比核小体更短的外显子的剪接位点上,通过阻滞RNAPII的活动促使它们被包含 | ||
| H1.6 | 睾丸特异性 | ||
| H1T2 | - | ||
| H1oo | - | ||
| HILS1 | - | ||
| H1X | 富集在RNAPII富集的区域;对星形胶质瘤不良预后的预示因素 | ||
| H1.0 | 在核小体相关域富集;在肿瘤细胞中通常呈不均匀表达,H1.0水平与肿瘤细胞分化和患者生存率相关 | ||
表1. 哺乳动物组蛋白变异体
表格信息来源: https://www.sciencedirect.com/science/article/pii/S0022283620305866和https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8015243/
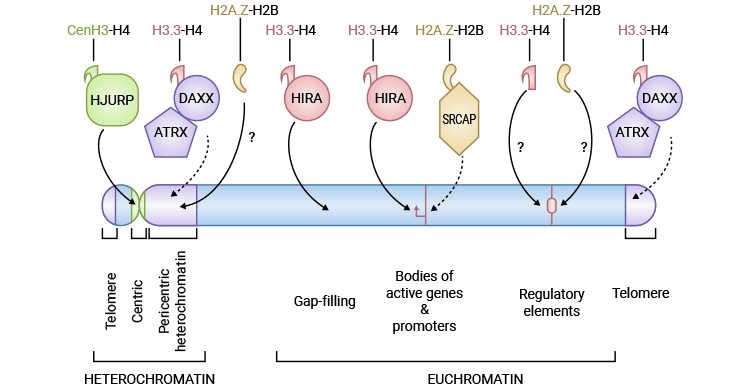
图1. 组蛋白变体的特性
3. 组蛋白变体的功能
组蛋白变体通过影响组蛋白后转录修饰和组蛋白变体特异性结合伙伴的招募,影响核小体稳定性和高阶染色质组织 [3,6]。组蛋白变体在几乎所有DNA模板过程中发挥关键作用,例如DNA修复,染色体分离,转录调控,基因组稳定性,表观遗传,甚至组织特异性功能 [2,3]。
例如,着丝粒特异性变体着丝粒蛋白A(CENP-A)作为染色体着丝粒区的表观遗传标志,而H3.3与染色质动态和核小体周转密切相关。此外,许多不同的H2A变体参与DNA修复,基因调控和其他关键过程,从而影响DNA组织。因此,组蛋白变体表达和沉积的失调可能导致发育综合症和癌症。
4. 组蛋白变体与疾病
由于组蛋白变体具有普遍表达和多效性效应,它们与正常生理和许多疾病,包括发育性疾病和癌症有关,这并不奇怪。例如,由于组蛋白变体可能是后期分化组织(如大脑)中新组蛋白的唯一来源,组蛋白变体可能在大脑相关疾病(如神经发育和神经退行性疾病)中发挥重要作用。实际上,一些研究表明,H3.3和H2A.Z变体对大脑功能至关重要 [7-9]。
此外,鉴于许多组蛋白变体是睾丸特异性的,替代或修改睾丸特异性组蛋白变体可能导致男性不育 [10]。
众所周知,许多癌症和发育性综合症携带编码染色质相关蛋白,包括组蛋白变体及其沉积特异性伙伴的基因的复发性突变。研究表明,H3.3的突变在儿童神经胶质瘤和软骨母细胞瘤中频繁发现 [11, 12]。H2A.Z被证明具有致癌功能,而MacroH2A和H2A.X则抑制肿瘤发生。H2A.Z的上调在前列腺和膀胱癌中发现 [13, 14]。随着黑色素瘤、膀胱癌和肛门肿瘤的疾病进展,MacroH2A的表达下降 [15, 16]。
参考文献:
[1] S.G. Franklin, A. Zweidler. Non-allelic variants of histones 2a, 2b and 3 in mammals [J]. Nature, 266 (1977), pp. 273-275.
[2] Talbert PB, Henikoff S. 2010. Histone variants--ancient wrap artists of the epigenome [J]. Nat Rev Mol Cell Biol 11:264–275.
[3] Martire S, Banaszynski LA. 2020. The roles of histone variants in fine-tuning chromatin organization and function [J]. Nat Rev Mol Cell Biol 21:522–541.
[4] Henikoff S, Smith MM. 2015. Histone variants and epigenetics [J]. Cold Spring Harb Perspect Biol 7:a019364.
[5] Talbert PB, Henikoff S. 2017. Histone variants on the move: substrates for chromatin dynamics [J]. Nat Rev Mol Cell Biol 18:115–126.
[6] Buschbeck M., Hake S.B. Variants of core histones and their roles in cell fate decisions, development and cancer [J]. Nat. Rev. Mol. Cell Biol. 2017;18:299–314.
[7] Xia W & Jiao J Histone variant H3.3 orchestrates neural stem cell differentiation in the developing brain [J]. Cell Death Differ. 24, 1548–1563 (2017).
[8] Stefanelli G et al. Learning and age-related changes in genome-wide H2A.Z binding in the mouse hippocampus [J]. Cell Rep. 22, 1124–1131 (2018).
[9] Zovkic IB, Paulukaitis BS, Day JJ, Etikala DM & David Sweatt J Histone H2A.Z subunit exchange controls consolidation of recent and remote memory [J]. Nature 515, 582–586 (2014).
[10] Govin J et al. Pericentric heterochromatin reprogramming by new histone variants during mouse spermiogenesis [J]. J. Cell Biol 176, 283–294 (2007).
[11] Schwartzentruber J et al. Driver mutations in histone H3.3 and chromatin remodelling genes in paediatric glioblastoma [J]. Nature 482, 226–231 (2012).
[12] Behjati S et al. Distinct H3F3A and H3F3B driver mutations define chondroblastoma and giant cell tumor of bone [J]. Nat. Genet 45, 1479–1482 (2013).
[13] Dryhurst D., Ausió J. Histone H2A.Z deregulation in prostate cancer. Cause or effect [J]? Cancer Metastastis Rev. 2014;33:429–439.
[14] Kim K., Punj V., et al. Gene dysregulation by histone variant H2A.Z in bladder cancer [J]. Epigenetics Chromatin. 2013;6:1–13.
[15] Kapoor A., Goldberg M.S., et al. The histone variant macroH2A suppresses melanoma progression through regulation of CDK8 [J]. Nature. 2010;468:1105–1109.
[16] Hu W.-H., Miyai K., et al. Loss of histone variant macroH2A2 expression associates with progression of anal neoplasm [J]. J. Clin. Pathol. 2016;69:627–631.






