肿瘤微环境中肿瘤相关巨噬细胞的代谢表型
日期:2020-12-25 15:09:00
就细胞群体而言,肿瘤微环境(TME)具备异质性。除癌细胞外,内皮细胞、成纤维细胞外、免疫炎症细胞在TME形成中起重要作用。炎症和免疫逃逸是肿瘤的两个标志性特征。肿瘤细胞可以通过分泌的细胞因子来驯化TME中的免疫细胞,使其获得肿瘤应援表型。肿瘤微环境中,比如肿瘤相关巨噬细胞(TAMs)、肿瘤相关中性粒细胞(TANs)、骨髓来源的抑制性细胞(MDSCs),是众多肿瘤中的主要免疫细胞组成。其中,TAMs所占的数量最多。有研究表明,巨噬细胞由休眠状态切换成高活性状态需要通过改变其代谢来赋能。那么,TME中TAMs代谢表型的改变是如何帮助TAMs完成功能切换的?这个问题引起了研究者的极大兴趣。读完这篇文章,相信你会有所了解。
1、什么是肿瘤微环境?
肿瘤微环境(tumor microenvironment)简称TME,主要由免疫细胞构成,如巨噬细胞、T淋巴细胞、自然杀伤细胞(NK细胞)、树突状细胞、嗜中性粒细胞等 (图1)。TME中细胞之间相互作用且彼此影响,各种细胞的代谢产物不仅是TME能量供应的来源,同时也介导了TME中不同细胞之间的信息传递 [1]。
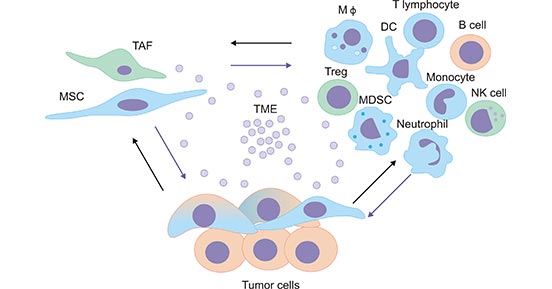
图1. 肿瘤微环境
*图片来源于Mediators of inflammation 出版物[1]。
2、什么是肿瘤相关巨噬细胞?
肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是TME中一种可塑性异质细胞群体,占某些实体肿瘤的50%,TAMs通过合成和分泌多种细胞因子,对TME产生广泛的影响 [2]。在微环境中,TAMs极化成M1/M2型TAMs,表达相应的特异性基因,行使不同的功能。M1型TAMs具有高水平的有氧糖酵解活性,可以产生活性氧(ROS)以杀死病原体介导抗肿瘤过程。相反,M2型TAMs则依赖于高水平的氧化磷酸化,可以产生IL-10和VEGF促进恶性肿瘤细胞的生长[3]。因此,TAMs的代谢情况具有动态性,对TAMs生存有很大影响。如图2,巨噬细胞转变为TAMs是一个复杂的过程,TME中的TAMs细胞代谢表型发生变化,并且与肿瘤细胞相互作用,共同影响肿瘤的代谢表型 [4]。因此,研究TME中TAMs的代谢变化对肿瘤进展和治疗抵抗有着重要的意义,将有助于开发新型抗肿瘤药物的潜在靶点。
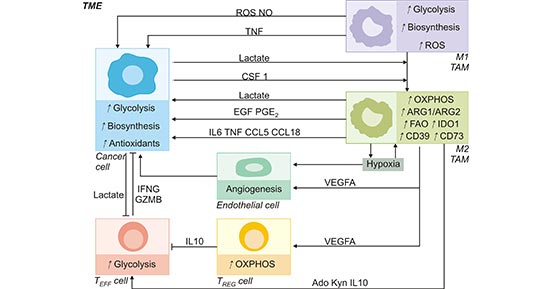
图2. 肿瘤细胞与TAMs间的免疫代谢联系
*图片来源于Cell metabolism 出版物[4]。
3、肿瘤相关巨噬细胞的代谢表型
3.1 TAMs中的糖代谢
肿瘤细胞和正常细胞之间的糖代谢存在本质上的差异。我们知道在常氧条件下,正常细胞通过氧化磷酸化产生ATP,而肿瘤细胞高度依赖糖酵解。无论是否有氧气存在,糖酵解始终是肿瘤生长代谢的中心,这种现象被称为Warburg效应[5]。在TME中,TAMs与肿瘤细胞竞争营养物质,特别是葡萄糖。TAMs的葡萄糖代谢过程发生了与肿瘤细胞类似变化。TAMs同样具有高度活性的糖酵解。
TAMs可通过提供营养支持来促进肿瘤进展,其主要是通过分泌VEGFA,ADM,CXC趋化因子配体8(CXCL8)和CXCL12招募并激活血管上皮细胞,为其生长提供营养物质,从而促进肿瘤异常血管新生,然而由此产生的新生血管网络的结构和功能异常,使TME呈现不同程度的缺氧 [6,7]。研究表明,在低氧条件下TAMs上调REDD1(regulated in development and in DNA damage response 1),抑制mTOR。这将抑制TAMs对葡萄糖的摄入,同时抑制TAMs糖酵解 [8]。与此同时,导致TME中葡萄糖的含量增加,糖酵解增强,增加肿瘤细胞对葡萄糖的利用率,促进肿瘤异常血管的生成。另一方面,REDD1缺陷型TAMs能够通过激活mTOR、增加糖酵解而与邻近的内皮细胞竞争葡萄糖,从而促进血管结构的正常化,抑制肿瘤的转移 (图3)[8]。
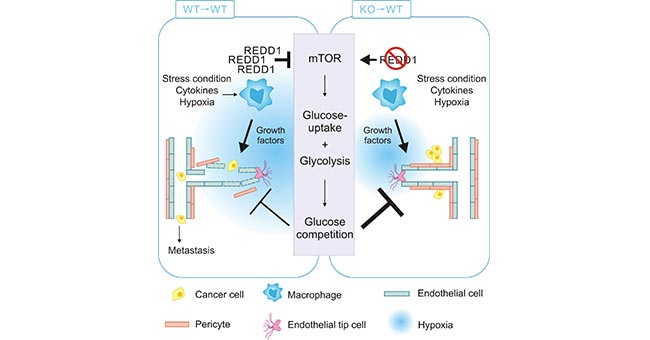
图3. REDD1缺陷型TAMs激活mTOR增加糖酵解
*图片来源于Cell metabolism 出版物[8]。
因而,抑制或增加TAMs糖酵解,可为肿瘤治疗提供新思路。有研究发现,人胰腺癌(PDCA)诱导的巨噬细胞具有较高的糖酵解活性,使用HK2竞争性抑制剂2-脱氧葡萄糖(2DG)抑制糖酵解可消除细胞的功能表型 [9]。在一些体外和体内研究中,2DG与靶向治疗联合,可有效的抑制癌细胞的活力、增殖和转移 [10]。除了HK2,作为糖酵解途径中的关键酶,磷酸果糖激酶 2(PFK2)、磷酸甘油激酶 1(PGK1)、乳酸脱氢酶 A(LDHA)、丙酮酸激酶 2(PKM2)、烯醇化酶(ENO1)、葡萄糖-6-磷酸脱氢酶(G6PD),是否可以通过靶向以上关键酶影响TAMs糖酵解产生抗肿瘤作用,将对肿瘤治疗有重大意义。所以,进一步的了解TAMs糖酵解相关机制,寻找TAMs糖酵解途径中的靶点是十分必要的。
3.2 TAMs中的脂质代谢
除了葡萄糖代谢外,TAMs的脂质代谢也发生改变。有研究发现在小鼠肺癌模型中,IL-1β诱导的表达环氧合酶2(COX2)的巨噬细胞可促进肿瘤生长和血管生成 [11]。此外,TAMs具有较高的长链脂肪醇氧化酶(FAO)水平,体内实验表明抑制长链脂肪醇氧化酶(FAO)可使小鼠肺癌和结肠癌模型中的TAMs由M2型向M1型极化 [12, 13]。与此相反,肿瘤细胞释放的巨噬细胞集落刺激因子1(CSF1)可诱导TAMs高表达脂肪酸合酶(FASN),由此生成的脂肪酸可激活过氧化物酶体增殖物激活受体δ(PPARD),其下游释放免疫抑制性细胞因子IL-10,从而诱导TAMs极化为M2型 [14-16]。
尽管TAMs呈现较高的FAO水平,但是某些TME中的TAMs仍会积聚细胞内脂质以维系自身代谢并发挥免疫调节作用。在这种情况下,这些TAMs中参与细胞内脂质代谢的多种蛋白表达均受到异常调控,如自水解酶结构域5蛋白(ABHD5),单甘油酯脂肪酶(MGLP),脂肪酸结合蛋白(FABP)以及中链酰基辅酶A脱氢酶(ACADM)[17, 18]。在肿瘤发展的早期阶段,TAMs高表达FABP5,导致TAMs分泌更多的Ⅰ型干扰素(IFN-1)以促进抗肿瘤免疫反应。而当肿瘤发展到晚期,TAMs高表达FABP4,FABP4可促进IL-6/STAT3的信号通路传导,从而促进肿瘤的发展 [17, 18]。
关于TAMs的脂质代谢机制,目前仍需要进一步的研究来揭示其相关的功能与肿瘤的关联,而文中提到的TAMs脂质代谢中的一些关键酶和极化机制,有望为肿瘤诊断及治疗的新方法。
3.3 TAMs中的氨基酸代谢
目前有少数的研究发现氨基酸代谢对TAMs功能重组可能有影响,然而这些研究大部分是观察性的,很少涉及机制的研究。有研究报道,在多种小鼠肿瘤模型中发现TAMs的精氨酸酶1(Arginase-1,ARG1)表达升高。ARG1一直被认为是M2型巨噬细胞的标志物。但是TAMs高表达的ARG1对恶性肿瘤的作用仍不清楚。缺氧和乳酸增高都能促进ARG1的表达,在小鼠肺癌模型中,敲除ARG1后,小鼠的肿瘤明显变小 [15]。
研究还发现,ARG2和催化色氨酸代谢分解的限速酶吲哚胺-2,3-双加氧酶1(IDO1),能大量消耗TME中对于免疫效应细胞营养代谢至关重要的氨基酸,如精氨酸和色氨酸,从而导致T细胞和NK细胞的功能失调 [19]。这也就意味着TAMs可诱导免疫抑制作用,引发TME中这些氨酸的消耗,进而破坏免疫监视作用。由此可见,TAMs氨基酸代谢中的相关酶在TAMs代谢机制中有重要的作用。
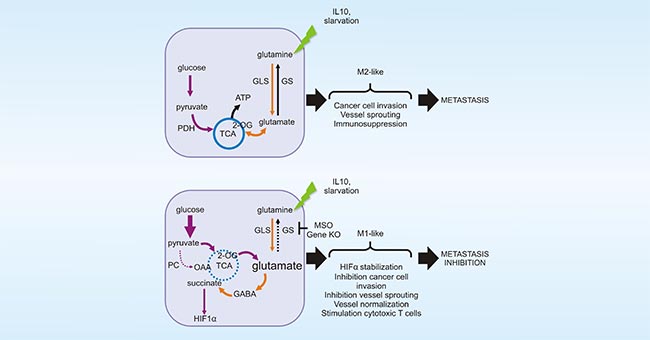
图4. 谷氨酰胺连接酶促进TAMs向M2型极化
*图片来源于Cell report 出版物[20]。
如前所述,巨噬细胞具有极强的可塑性。体外实验证明,谷氨酰胺连接酶(GLUL)可通过催化谷氨酸转化为谷氨酰胺(glutamine,Gln)来促进TAMs向M2型极化。抑制谷氨酰胺摄取则可促使小鼠肿瘤模型中的TAMs向M1型极化 [20] (图4)。通过将M2型TAMs极化为M1型TAMs来提高TAMs的吞噬能力抵抗肿瘤,也是目前研究的热点。
3.4 TAMs中的铁离子平衡
在寻找癌症的替代疗法当中,细胞新陈代谢过程中涉及的营养元素被认为是潜在的癌症治疗的靶标。随着对生物化学反应及代谢领域的认识不断提升,发现金属元素(如铁、铜和锌)参与了生物细胞生长发育各关键过程(其中也包括癌变过程)。在众多金属元素之中,铁元素(Fe)是生命体重要的必须微量元素,在细胞代谢和调控过程中有重要作用。
目前只有少量研究显示TAMs内铁代谢失调导致的铁离子浓度异常与肿瘤的发生、增殖与转移有关。前文提到,TAMs为肿瘤异常血管提供营养物质,但通常TME会呈现不同程度的缺氧 [6, 7]。TME的缺氧状态导致TAMs溶质载体家族40成员1(SLC40A1)和脂质运载蛋白2(LCN2)表达上调,这将抑制TAMs对铁离子的摄取,导致TME中铁离子蓄积,增强恶性肿瘤细胞对铁离子的摄取,进一步增强氧化应激,激活信号传导与活化转录因子3(STAT3)以及核转录因子-κB(NF-κB)等信号通路,最终促进肿瘤发展 [21, 22]。
我们知道肿瘤细胞对铁表现出更强的依赖性,同时更容易消耗铁。尽管有大量的研究,但铁和癌症之间的具体联系仍然没有完全解释清楚。研究TAMs中的铁离子平衡机制,这可能为预测癌症预后和治疗提供新方法。
近些年来,针对TAMs的抗肿瘤免疫疗法的研究取得显著进展。一方面,造成肿瘤细胞糖酵解增强的主要原因与糖酵解酶的表达、活性增强有关。研究发现,抑制或促进TAMs糖酵解过程将影响TEM肿瘤细胞进展。一些关键酶,作为一种新的高敏感性肿瘤标志物,在恶性肿瘤的诊断、预后等方面显示出了很好的前景。另一方面,TAMs包含两种可以相互极化的亚型:M1型TAMs发挥着抑制肿瘤生长的作用,而M2型TAMs对肿瘤的发生发展起促进支持作用。在肿瘤的发生发展过程中,TAMs更倾向于极化成M2型。基于肿瘤相关巨噬细胞两种亚型的功能特点,我们有望通过TAMs代谢重编程来改变TAMs极化,使其发挥抗肿瘤效应。然而更为全面的了解和清楚揭示TAMs代谢机制对肿瘤起源、TAMs极化以及功能方面的影响,将是抗肿瘤免疫疗法新的挑战与机遇。
参考文献:
[1] Trivanović, Drenka, et al. "The roles of mesenchymal stromal/stem cells in tumor microenvironment associated with inflammation." Mediators of inflammation (2016).
[2] Vinogradov, Serguei, Galya Warren, and Xin Wei. "Macrophages associated with tumors as potential targets and therapeutic intermediates." Nanomedicine (2014): 695-707.
[3] Lin, Yuxin, Jianxin Xu, and Huiyin Lan. "Tumor-associated macrophages in tumor metastasis: biological roles and clinical therapeutic applications." Journal of hematology & oncology (2019): 76.
[4] Vitale, Ilio, et al. "Macrophages and metabolism in the tumor microenvironment." Cell metabolism (2019): 36-50.
[5] Jeong, Hoibin, et al. "Tumor-associated macrophages enhance tumor hypoxia and aerobic glycolysis." Cancer research (2019): 795-806.
[6] Biswas SK, Allavena P, Mantovani A. “Tumor-associated macrophages: functional diversity, clinical significance, and open questions.” InSeminars in immunopathology (2013): 585-600.
[7] Hughes, Russell, et al. "Perivascular M2 macrophages stimulate tumor relapse after chemotherapy." Cancer research (2015): 3479-3491.
[8] Wenes, Mathias, et al. "Macrophage metabolism controls tumor blood vessel morphogenesis and metastasis." Cell metabolism (2016): 701-715.
[9] Rabold, Katrin, et al. "Cellular metabolism of tumor‐associated macrophages–functional impact and consequences." Febs Letters (2017): 3022-3041.
[10] Netea-Maier, Romana T., Johannes WA Smit, and Mihai G. Netea. "Metabolic changes in tumor cells and tumor-associated macrophages: a mutual relationship." Cancer letters (2018): 102-109.
[11] Nakao, Shintaro, et al. "Infiltration of COX-2–expressing macrophages is a prerequisite for IL-1β–induced neovascularization and tumor growth." The Journal of clinical investigation (2005): 2979-2991.
[12] Liu, Pu-Ste, et al. "α-ketoglutarate orchestrates macrophage activation through metabolic and epigenetic reprogramming." Nature immunology (2017): 985-994.
[13] Choi, Judy, et al. "Glioblastoma cells induce differential glutamatergic gene expressions in human tumor-associated microglia/macrophages and monocyte-derived macrophages." Cancer biology & therapy (2015): 1205-1213.
[14] Jha, Abhishek K., et al. "Network integration of parallel metabolic and transcriptional data reveals metabolic modules that regulate macrophage polarization." Immunity (2015): 419-430.
[15] Brüne, Bernhard, Andreas Weigert, and Nathalie Dehne. "Macrophage polarization in the tumor microenvironment." Redox Biology (2015): 419.
[16] Hossain, Fokhrul, et al. "Inhibition of fatty acid oxidation modulates immunosuppressive functions of myeloid-derived suppressor cells and enhances cancer therapies." Cancer immunology research (2015): 1236-1247.
[17] Hao, Jiaqing, et al. "Expression of adipocyte/macrophage fatty acid–binding protein in tumor-associated macrophages promotes breast cancer progression." Cancer research (2018): 2343-2355.
[18] Xiang, Wei, et al. "Monoacylglycerol lipase regulates cannabinoid receptor 2-dependent macrophage activation and cancer progression." Nature communications (2018): 1-13.
[19] Carmona-Fontaine, Carlos, et al. "Metabolic origins of spatial organization in the tumor microenvironment." Proceedings of the National Academy of Sciences (2017): 2934-2939.
[20] Palmieri, Erika M., et al. "Pharmacologic or genetic targeting of glutamine synthetase skews macrophages toward an M1-like phenotype and inhibits tumor metastasis." Cell reports (2017): 1654-1666.
[21] Mertens, Christina, et al. "Intracellular iron chelation modulates the macrophage iron phenotype with consequences on tumor progression." PloS one (2016): e0166164.
[22] Ören, Bilge, et al. "Tumour stroma‐derived lipocalin‐2 promotes breast cancer metastasis." The Journal of pathology (2016): 274-285.










