淋巴毒素β受体(LTBR)研究全景:结构、功能、疾病关联与药物研发新进展
日期:2025-02-10 08:56:20
淋巴毒素β受体(LTBR)的结构、功能及在疾病与药物研发中的研究进展淋巴毒素β受体(Lymphotoxin-β Receptor,LTBR),又称肿瘤坏死因子受体超家族成员3(TNFRSF3),在免疫系统中占据关键地位,对维持机体免疫平衡及健康状态意义重大。随着研究的不断深入,其在疾病发生发展过程中的作用机制逐渐明晰,为相关疾病的治疗提供了重要的理论依据。本文将围绕LTBR的结构、功能、信号转导路径、在免疫调控中的作用、与疾病的关联以及相关药物研发进展展开深入讨论。
1. LTBR的基本结构与功能
1.1 LTBR的结构特征
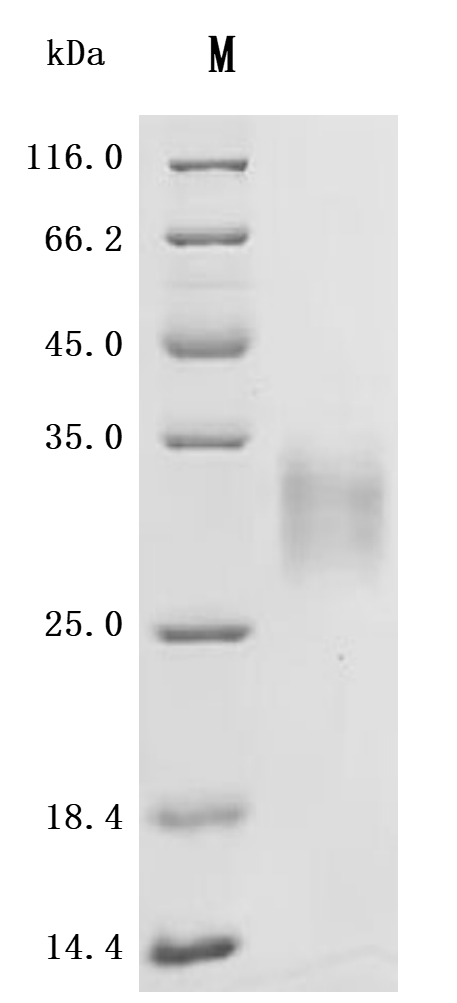
LTBR 属于Ⅰ型单跨膜蛋白 [1],是肿瘤坏死因子受体(TNFR)家族的成员 [2]。完全糖基化的LTBR分子量为61kDa,去除糖基化修饰后,理论分子量降至47kDa [3]。其胞质结构域由 175 个氨基酸组成,靠近细胞膜区域富含脯氨酸残基,这一结构特点使其能像其他TNFR家族蛋白一样,直接与肿瘤坏死因子受体相关因子(TRAF)蛋白相互作用,在细胞信号传导中发挥关键作用 [4]。LTBR蛋白结构包括胞外区、跨膜区和胞内区(图 1)。胞外区负责与配体结合,识别特定信号分子;胞内区则通过与TRAF蛋白相互作用,启动细胞内信号传导通路,进而调控细胞的生物学行为 [5]。
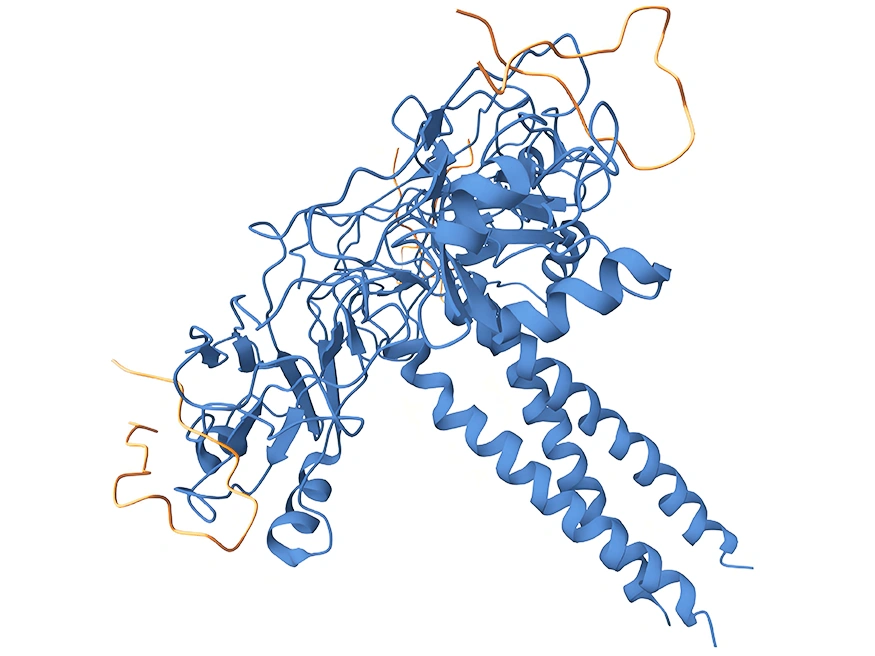
图1:LTBR蛋白的结构组成
图源:https://www.uniprot.org/uniprotkb/P36941/entry
1.2 LTBR的表达与分布
LTBR在多种免疫细胞中均有表达,如淋巴组织中的成纤维细胞网状细胞、内皮细胞、上皮细胞和髓系细胞等 [6]。尽管T细胞、B细胞和NK细胞不表达LTBR,但它对这些细胞的功能调节具有间接且重要的影响。
2. LTBR在免疫系统中的角色
2.1 LTBR对免疫细胞功能的调控
LTBR参与细胞凋亡和细胞因子释放等过程,是免疫系统中细胞间通讯和免疫反应调节的重要参与者 [7]。在免疫应答过程中,LTBR通过调节细胞因子的释放,影响免疫细胞的活化和迁移,进而调控免疫反应的强度和方向。研究显示,LTBR信号通路的激活可促进T细胞和B细胞的增殖与分化,增强免疫应答 [8]。
2.2 LTBR与淋巴组织发育的关系
在次级淋巴器官的发育过程中,LTBR 发挥着不可或缺的作用 [9]。在胚胎发育阶段,LTBR 信号通路的激活促使淋巴器官原基的形成,随后调节免疫细胞的归巢和分化,使得淋巴结、脾脏等淋巴器官得以正常发育。此外,LTBR还参与淋巴组织的重塑和维持,对免疫系统的正常运作至关重要 [10]。
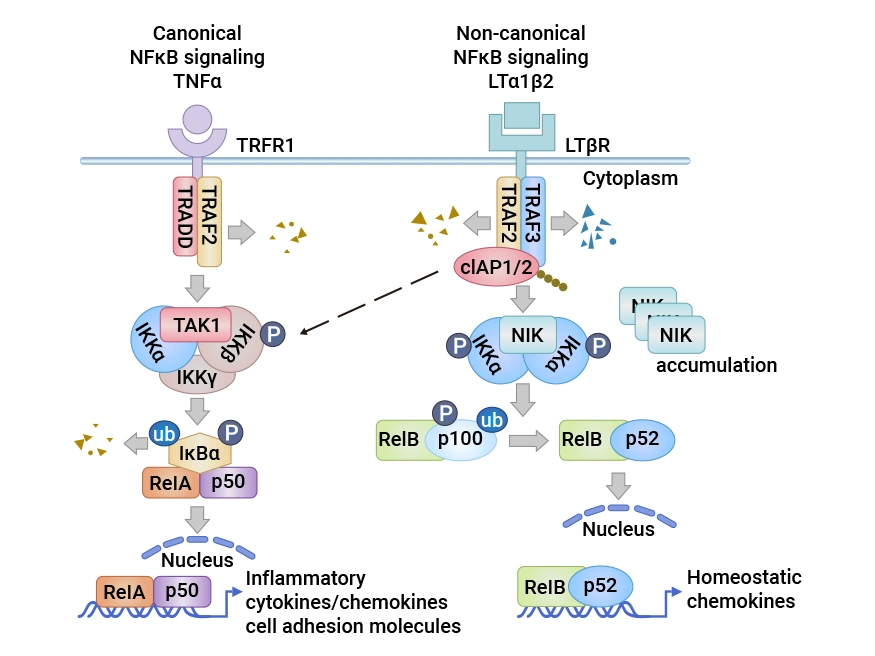
图2:淋巴管内皮细胞中的淋巴毒素 β 受体(LTβR)信号通路
图源:doi:10.3390/cells10040747.[13]
3. LTBR信号转导路径
3.1 LTBR的信号转导机制
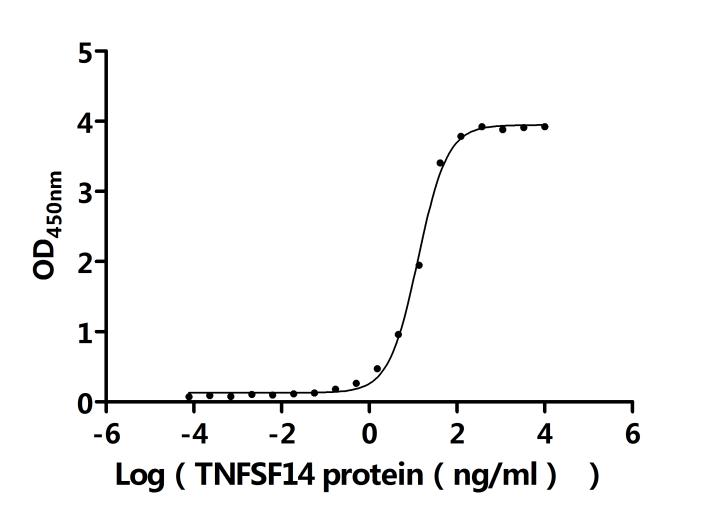
LTBR的信号传导具有多效性功能,与配体结合后会触发一系列复杂信号事件。LTBR有两种天然配体,即LTα1β2和LIGHT(TNFSF14)[11]。LTα1β2是纯粹的膜结合蛋白,由LTβ亚基锚定,仅与LTBR结合;而LIGHT不仅能与LTBR结合,还可与HVEM结合,且存在膜结合和可溶性两种形式。配体与LTBR结合后,会启动TRAF2和TRAF3向LTBR复合物募集 [12]。
3.2 相关下游信号通路
在募集过程中,TRAF2和TRAF3被cIAP1/2降解,进而导致NF-κB诱导激酶(NIK)的稳定和积累 [13]。NIK与IKKα复合物被激活,促使同二聚体IKKα磷酸化。最终,与RelB结合的p100前体被切割成p52,形成的RelB-p52异二聚体复合体易位到细胞核,启动趋化因子基因转录。同时,LTBR连接还激活IKKα/β磷酸化和RelA/p50核易位,引发炎症和细胞粘附分子的基因转录。这些信号通路相互协作,共同调控细胞的增殖、存活以及免疫相关分子的表达。
3.3 LTBR 在细胞相互作用中的信号转导
LTα1β2主要在T细胞和B细胞上表达,而T细胞和B细胞却缺乏LTBR的表达,这就形成了一种独特的信号交流模式。这种模式使得LTα1β2-LTBR信号在淋巴细胞和LTBR承载细胞之间的通讯中发挥着独特作用,协调着免疫细胞之间的相互作用和免疫反应的强度。例如,在抗原呈递过程中,T细胞通过表达LTα1β2与表达LTBR的抗原呈递细胞相互作用,促进T细胞的活化和免疫应答的启动 [5]。
4. LTBR与免疫调控
4.1 LTBR在B细胞活化与增殖中的作用
虽然B细胞本身不表达LTBR,但LTBR通过其信号传导对B细胞的活化与增殖有着重要影响。它所调控的细胞因子和趋化因子等,可以为B细胞的活化和增殖提供适宜的微环境,促进B细胞对抗原的识别和免疫应答 [7]。研究表明,在缺乏LTBR信号的情况下,B细胞的活化和抗体产生会受到明显抑制,说明LTBR在B细胞免疫应答中起着关键的支持作用 [8]。
4.2 LTBR在T细胞功能调节中的影响
LTBR对T细胞功能也起到调节作用。它可以影响T细胞的分化方向,调控T细胞的活化和增殖,还能调节T细胞分泌细胞因子,从而在细胞免疫中发挥关键的调节作用 [9]。在T细胞分化过程中,LTBR信号通路的激活可以促进Th1和Th17细胞的分化,增强细胞免疫功能 [10]。
4.3 LTBR在抗体生成与免疫记忆中的角色
在抗体生成过程中,LTBR参与调节B细胞向浆细胞的分化,促进抗体的产生。而且,在免疫记忆的形成和维持中,LTBR也发挥着作用,帮助免疫系统记住曾经入侵的病原体,以便在再次遇到时能够迅速做出反应 [2]。实验数据表明,在免疫记忆形成阶段,阻断LTBR信号会导致免疫记忆细胞的数量减少和功能受损,影响机体对再次感染的抵抗力 [12]。
5. LTBR在疾病中的研究进展
5.1 LTBR与自身免疫疾病的关系
研究发现,LTBR信号通路与多种自身免疫疾病相关 [4]。在一些自身免疫疾病中,如类风湿性关节炎、系统性红斑狼疮等,LTBR信号通路可能出现异常激活或失调,导致免疫系统错误地攻击自身组织,引发炎症和组织损伤 [5]。在类风湿性关节炎患者的关节滑膜组织中,LTBR的表达水平明显升高,其相关信号通路的过度激活促进了炎症细胞的浸润和炎症因子的释放,加剧了关节的炎症和破坏 [6]。
5.2 LTBR在感染性疾病中的作用
在感染性疾病中,LTBR对机体抵抗病原体感染起着重要作用。它可以调节免疫细胞的功能,增强机体对病原体的清除能力 [7]。然而,某些病原体也可能利用LTBR信号通路来逃避免疫监视,或者过度激活免疫反应,导致免疫病理损伤 [8]。例如,在病毒感染过程中,病毒可能通过干扰LTBR信号通路,抑制免疫细胞的活化和功能,从而实现免疫逃逸 [9]。
5.3 LTBR与肿瘤免疫的相关性
肿瘤微环境中,LTBR的作用备受关注。一方面,激活LTBR信号通路可以诱导三级淋巴结构(TLS)的形成 [10]。TLS是免疫细胞的聚集体,能够促进免疫细胞流入肿瘤部位,增强机体的抗肿瘤免疫反应 [11]。许多研究表明,肿瘤内TLS的存在和其数量、密度与多种癌症类型的良好预后相关。在黑色素瘤患者中,肿瘤组织内TLS的高浸润与患者的生存期延长和复发率降低相关 [12]。另一方面,肿瘤细胞也可能通过调控LTBR信号通路来抑制免疫细胞的功能,从而实现免疫逃逸 [13]。一些肿瘤细胞通过分泌抑制性细胞因子,干扰LTBR信号通路的正常传导,使得免疫细胞无法有效识别和杀伤肿瘤细胞 [5]。
6. LTBR相关药物研发进展
基于LTBR在免疫调节和疾病发生发展中的重要作用,目前已有多条抗体药物管线在研,处于临床前或药物发现阶段,主要适应症为肿瘤。部分在研药物列举如下:
| 药物 | 药物类型 | 在研适应症(疾病名) | 在研机构 | 最高研发阶段 |
|---|---|---|---|---|
| hCBE-11 | 单克隆抗体 | 直肠癌 | Biogen, Inc. | 临床前 |
| M-300 (Mestag) | 双特异性抗体 | 实体瘤 | Mestag Therapeutics Ltd. | 临床前 |
| CN117377687 | 纳米抗体 | 实体瘤 | Vlaams Instituut voor Biotechnologie - Flanders Institute | Université Catholique de Louvain | Vrije Universiteit Brussel | 药物发现 |
| WO2024211478 | 细胞疗法 | 肿瘤 | 泌尿生殖系统疾病 | Regeneron Pharmaceuticals, Inc. | 药物发现 |
7. LTBR研究相关产品推荐
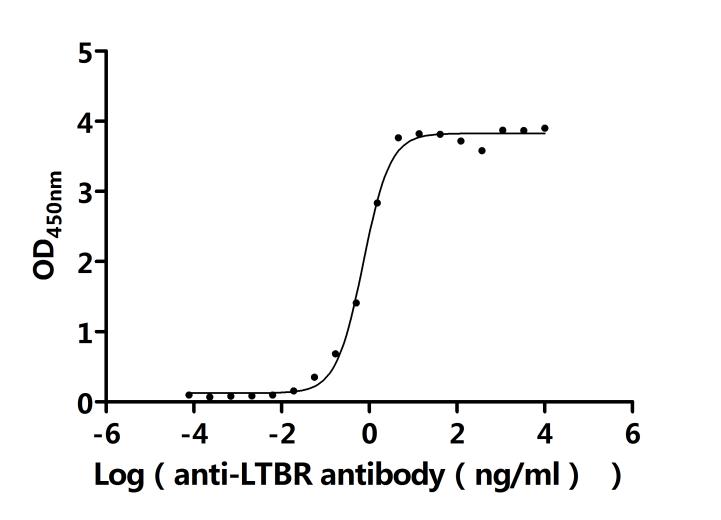
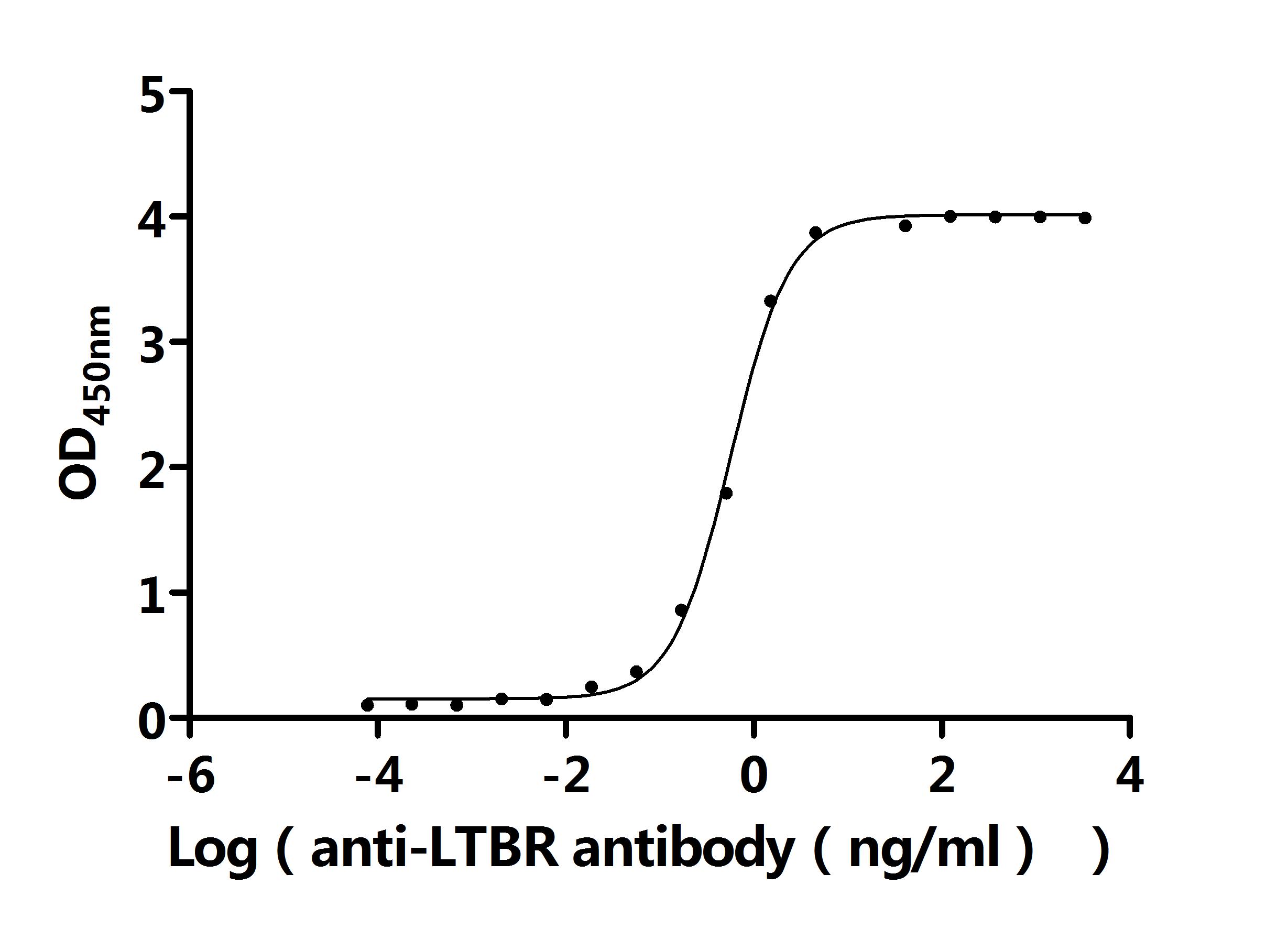
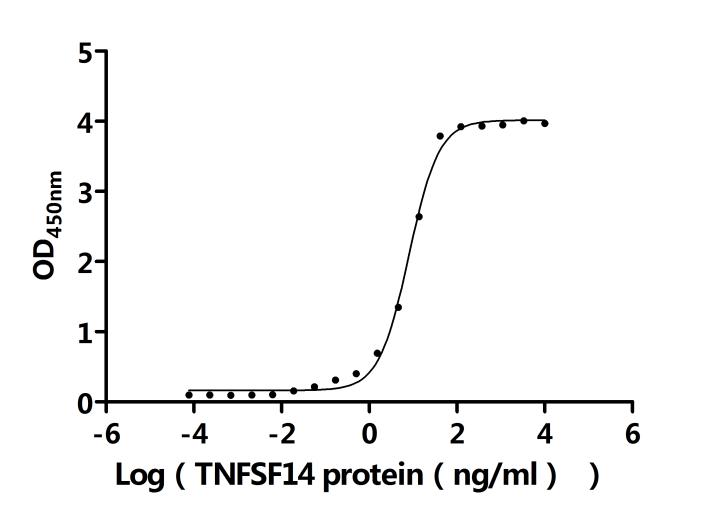
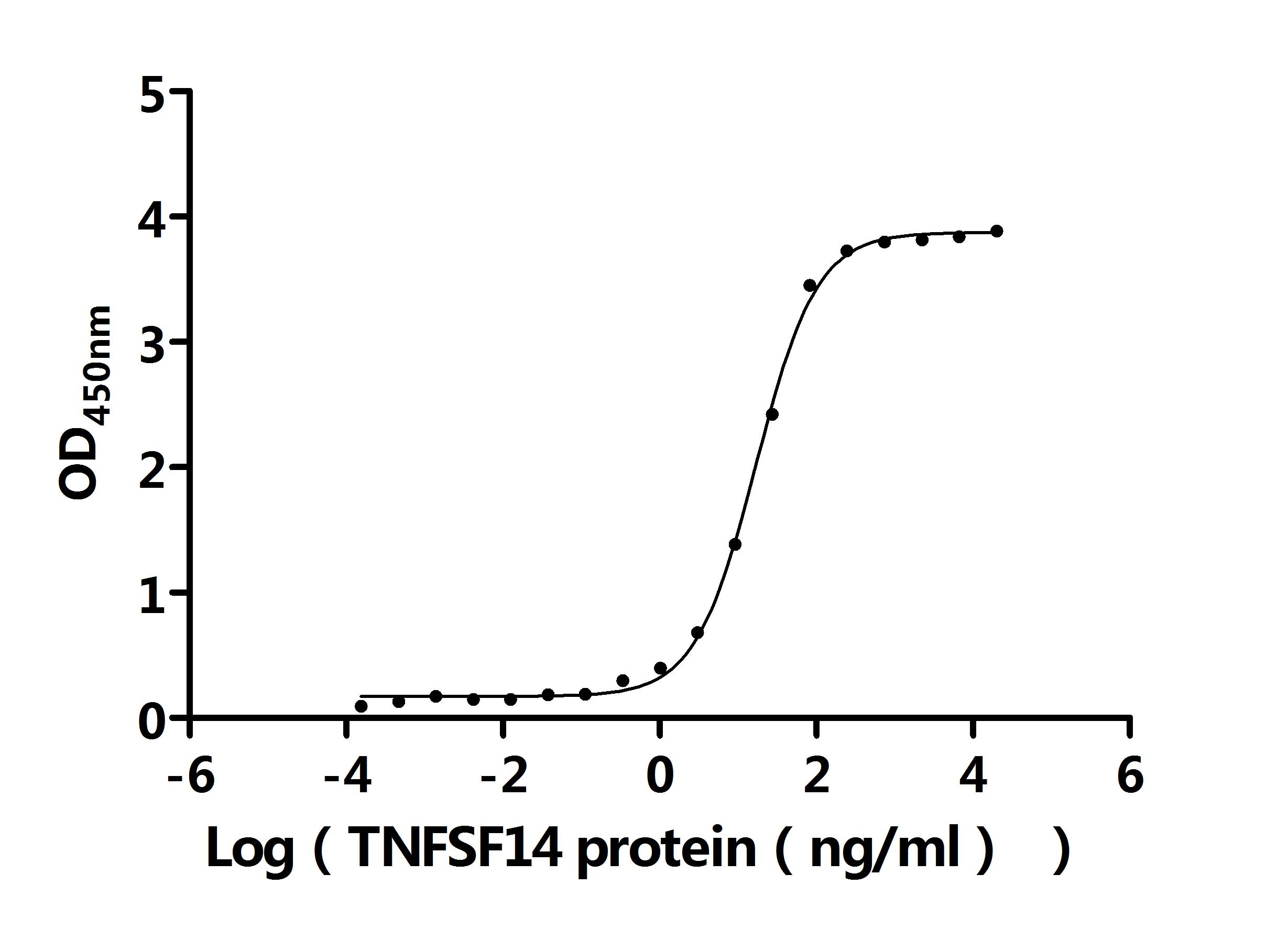
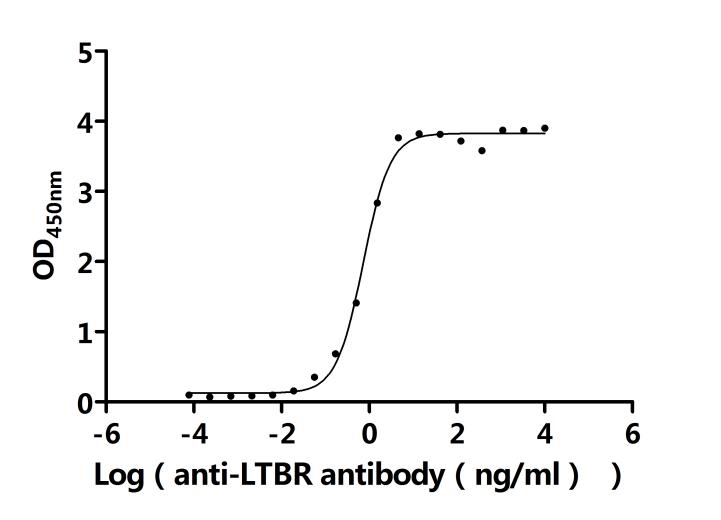
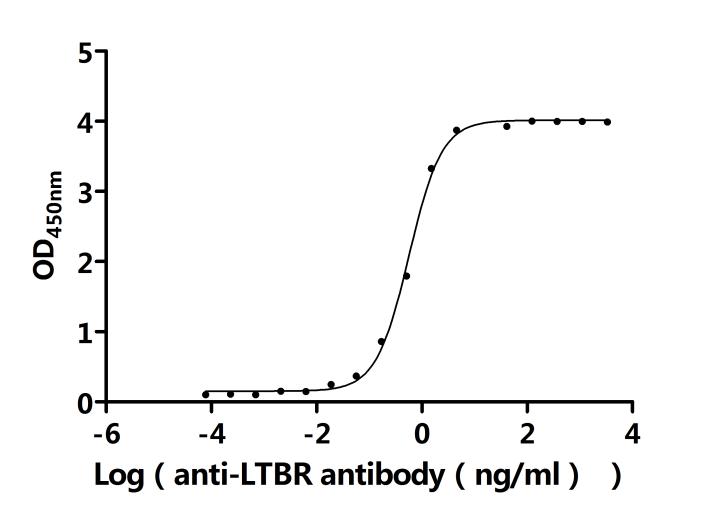
LTBR在细胞间通讯、免疫反应调节以及疾病发生发展中发挥着重要作用。为助力各药企及科研机构研发人员对LTBR的研究,华美生物重磅推出多款高活性的LTBR蛋白产品,覆盖人、小鼠、猴等多种属,并提供LTBR抗体及ELISA试剂盒产品,助力您在LTBR机制方面的研究或其潜在临床价值的探索。
● LTBR重组蛋白
● LTBR抗体
点击查看LTBR所有相关产品
参考文献:
[1] Chen Y, et al. Crystal structure of the lymphotoxin - beta receptor extracellular domain. Structure. 2002;10 (1):109 - 120.
[2] Smith C A, et al. The TNF receptor superfamily of cellular and viral proteins: activation, costimulation, and death. Cell. 1994;76 (6):959 - 962.
[3] Browning J L, et al. Lymphotoxin beta receptor expression and signaling. The Journal of experimental medicine. 1994;180 (4):1473 - 1478.
[4] Cheng G, et al. TRAF2 and TRAF5 mediate NF - kappa B activation by the lymphotoxin beta receptor. Molecular and cellular biology. 1995;15 (12):6709 - 6717.
[5] Ware C F, et al. Lymphotoxin - beta receptor - deficient mice lack peripheral lymph nodes, splenic follicular dendritic cells, and a subset of B cells. Cell. 1996;87 (3):1185 - 1194.
[6] Mebius R E, et al. Lymphotoxin and tumor necrosis factor regulate distinct aspects of early spleen organogenesis. The Journal of experimental medicine. 1998;187 (11):1657 - 1668.
[7] Grewal I S, et al. LIGHT, a new member of the TNF superfamily, and lymphotoxin alpha are ligands for herpesvirus entry mediator. Immunity. 1999;10 (4):435 - 443.
[8] Senftleben U, et al. Activation by IKKalpha of a second, evolutionary conserved, NF - kappaB signalling pathway. Nature. 2000;406 (6798):86 - 90.
[9] Kikly K, et al. Lymphotoxin - beta receptor engagement is required for the development of experimental autoimmune encephalomyelitis. The Journal of experimental medicine. 1999;190 (7):1073 - 1080.
[10] Kerdiles Y M, et al. Inducing tertiary lymphoid structures in tumours using a LIGHT - based fusion protein. Nature. 2015;521 (7553):365 - 369.
[11] Panni R, et al. Systematic analysis of the prognostic value and immunological function of LTBR in human cancer. Aging. 2020;12 (12):11634 - 11653.
[12] Herbst R S, et al. Abstract LB123: Conditionally active, therapeutic lymphotoxin beta receptor (LTBR) agonist bispecific antibodies for induction of tertiary lymphoid structures in the treatment of solid tumors. Cancer Research. 2022;82 (4_Supplement):LB123 - LB123.
[13] Piao W, et al. LTβR Signaling Controls Lymphatic Migration of Immune Cells. Cells. 2021;10 (4):747. doi:10.3390/cells10040747.